La sélection clonale
La sélection clonale est réalisée selon une procédure précise faisant appel à un savoir-faire et à des techniques qui ont été développés à l’ENTAV depuis 1962 et qui continuent de l’être par l’IFV et ses partenaires.


Vue aérienne du Domaine de l’Espiguette
L’Institut Français de la Vigne et du Vin
L’Institut Français de la Vigne et du Vin (IFV) émane de la fusion entre les deux instituts de la fi lière viti-vinicole, ENTAV et ITV France. Conformément à l’arrêté interministériel du 12 mars 2007, ce centre technique industriel a pour mission de conduire des études de portée générale et des programmes de recherche appliquée pour l’ensemble de la fi lière viti-vinicole, dans les domaines de la sélection variétale, de la viticulture, de la vinifi cation et de la mise en marché des produits. Deux types d’actions sont mis en œuvre : un programme national de maîtrise de la qualité tout au long de la chaîne de production/transformation dans le respect de l’environnement, et des programmes régionalisés prenant en considération les techniques particulières et les intérêts propres de chaque bassin viticole.
Matériel végétal
Les principales missions de l’IFV sont la conduite et la coordination des travaux de sélection clonale, sanitaire et génétique, des différents cépages et porte-greffes, la conservation du matériel sélectionné et le maintien de la diversité génétique naturelle, la production du matériel végétal et sa diffusion auprès de la fi lière des bois et plants de vigne. L’Institut intervient également en matière de recherche appliquée sur les maladies à virus et à phytoplasmes, les dépérissements et la mise au point de techniques d’identifi cation variétale et clonale par analyses moléculaires.
Vigne et terroir
Les projets de recherche s’inscrivent dans une logique d’adaptation de la production de raisins en vue de l’obtention de produits de qualité, adaptés à la demande du consommateur et obtenus dans des conditions intégrées, respectueuses de l’homme, de l’environnement et des terroirs viticoles. Ces projets prennent en compte les coûts de production.
Vin et marché
Les études intègrent deux enjeux fondamentaux pour la fi lière viti-vinicole : l’évolution très importante du marché et le nécessaire développement d’une viti-viniculture durable. Les attentes des consommateurs sont au centre des préoccupations notamment en ce qui concerne les divers modes de consommation, les préoccupations fortes pour la santé, l’alimentation et les modes de vie.
Les acteurs de la sélection clonale
Le Pôle Matériel végétal – Domaine de l’Espiguette
La sélection clonale est réalisée selon une procédure précise faisant appel à un savoir-faire et à des techniques qui ont été développés à l’ENTAV depuis 1962 et qui continuent de l’être par l’IFV et ses partenaires. Les principaux objectifs sont d’améliorer le potentiel du matériel végétal viticole tout en maintenant l’ensemble des caractéristiques et l’identité de chaque variété. L’IFV contribue également à la préservation du patrimoine viticole français à travers la mise en place des conservatoires régionaux. Cette activité constitue un véritable maillon entre la recherche et la production dont l’originalité repose sur sa structure, ses opérations et ses résultats. Le Pôle Matériel végétal de l’IFV est situé sur le Domaine de l’Espiguette, occupant 80 hectares sur la commune du Grau du Roi dans le Gard. Ce site a été choisi pour héberger le conservatoire national des clones car les sols sont constitués de sables purs du littoral méditerranéen, ne contenant ni phylloxéra ni nématodes ectoparasites vecteurs du court-noué. Plus de 38 ha sont plantés en collections de clones et parcelles de prémultiplication auxquels s’ajoutent les pépinières.
L’INRA
Cet Institut a joué un rôle important dans la mise en place de la sélection clonale en France, en établissant les bases méthodologiques, tant génétiques que sanitaires, qui sont utilisées actuellement. Les stations d’amélioration d’Angers, Bordeaux, Colmar et Montpellier notamment ont conduit des programmes de sélection clonale pour un grand nombre de variétés. Récemment, afi n de concentrer son activité de sélection sur la création variétale, l’INRA a transféré la sélection clonale à des organismes professionnels appartenant au réseau de partenaires coordonné par l’IFV. Cela passe par l’instauration de plateformes (PTIV) s’appuyant sur l’infrastructure des Unités Expérimentales de l’INRA et sur son expertise dans le domaine des conservatoires génétiques des cépages qu’il maintient. L’étude des maladies virales est assurée par l’INRA de Colmar, qui mène des recherches notamment dans les domaines de la transmission des principales viroses et de l’amélioration de leur diagnostic pour la certifi cation. Les clones agréés qui ont été sélectionnés par l’INRA sont intégrés dans le dispositif national de diffusion confi é au pôle matériel végétal de l’IFV.
Le schéma de la sélection clonale en France
Un clone est la descendance végétative conforme à une souche choisie pour son identité indiscutable, ses caractères phénotypiques et son état sanitaire.
La sélection clonale est un processus long. Depuis les prospections menées dans des vieilles parcelles ou la présélection dans des conservatoires régionaux, jusqu’à l’agrément d’un clone et sa multiplication, il se passe en moyenne 15 ans. En effet, les programmes de sélection sanitaire et de sélection génétique nécessitent plusieurs années d’analyses et d’observations avant de pouvoir demander l’agrément à la section vigne du Comité Technique Permanent de la Sélection des plantes cultivées (CTPS). Elle est réalisée selon le schéma page suivante.
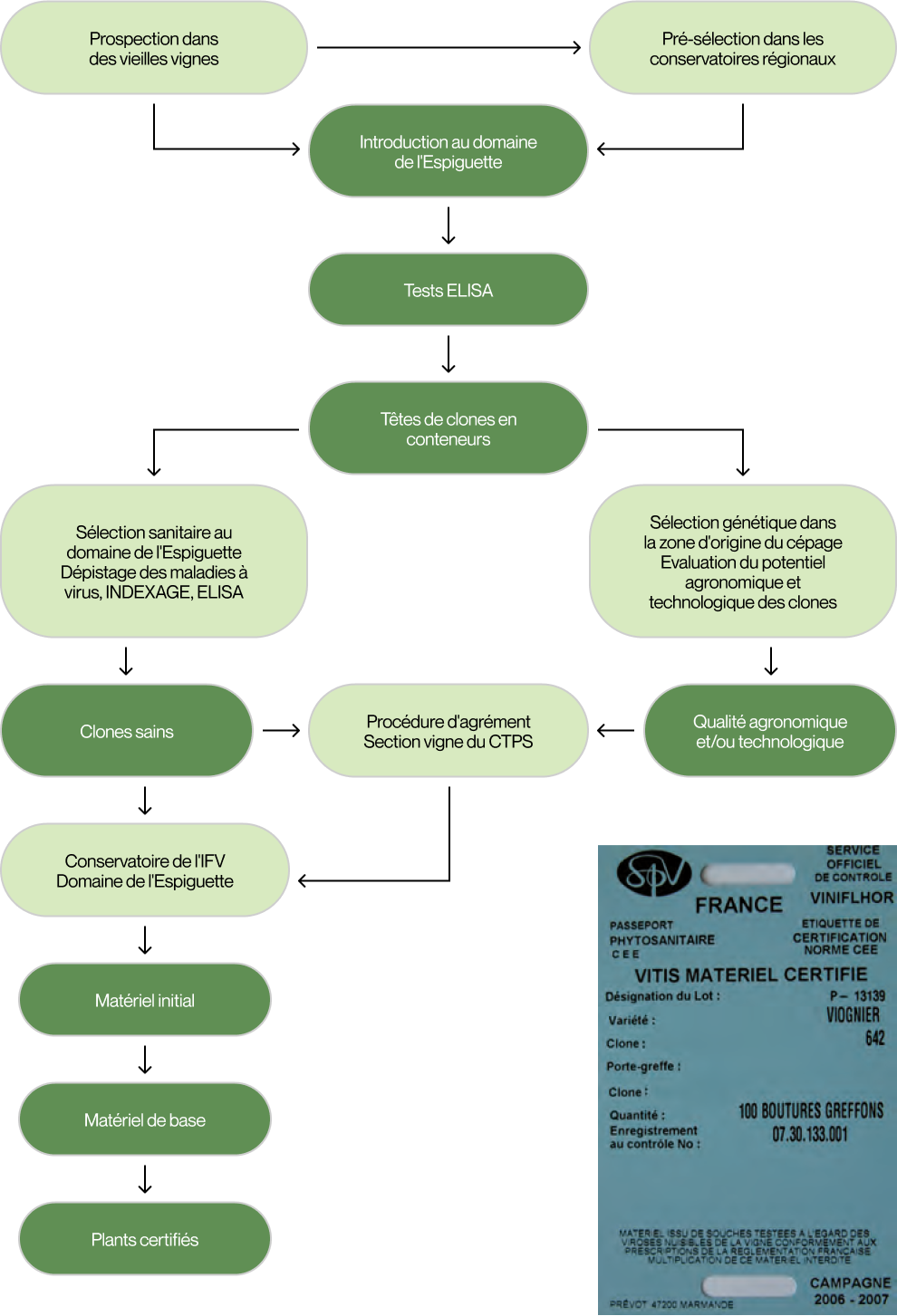
Sélection sanitaire
Les techniques de diagnostic utilisées pour le dépistage, ont évolué dans le temps en fonction des connaissances acquises sur les maladies à virus et du développement des méthodes et des outils de diagnostic. Dans un premier temps, le choix au vignoble des souches têtes de clones vise à éliminer les sujets présentant des symptômes visuels de viroses. Par la suite, le dépistage des viroses fait appel à différentes techniques.
Les techniques utilisées actuellement sont :
- L’indexage par greffage ligneux qui consiste à placer un greffon du clone à tester sur une bouture - dont un des bourgeons est conservé – d’une variété qui exprime et montre facilement les symptômes spécifi ques de la virose recherchée (variété indicatrice).
- L’indexage par greffage herbacé qui repose sur le même principe mais fait appel à la méthode de la greffe bouture herbacée ce qui permet une apparition des symptômes plus rapide en serre.
- Le test ELISA (Enzyme Linked Immuno Sorbent Assay) est une technique sérologique basée sur la réaction anticorps (sérum) – antigène (virus). La préparation des anticorps nécessite la purifi cation du virus si celui-ci est identifi é, ce qui n’est pas le cas pour toutes les maladies en cause. L’adjonction d’une enzyme aux anticorps permet de révéler la présence du virus par une réaction colorée si celui-ci est présent dans l’échantillon à tester. L’intensité de la coloration est mesurée par un spectrophotomètre et la densité optique ainsi obtenue de l’échantillon analysé est comparée à celle d’un échantillon témoin sain et à celle d’un échantillon témoin malade. Le test ELISA est une méthode rapide qui permet de réaliser un premier tri et d’éliminer les accessions infectées par les principales viroses (court-noué et enroulement). Les indexages ne sont alors réalisés que sur les têtes de clones ayant réagi négativement aux tests ELISA. Cette technique est également utilisée pour les analyses de vérifi cation.
”En tant que centre de sélection de renommée nationale et internationale, l’IFV s’est engagé dans des démarches qualité afi n de consolider sa position, sa réputation et sa détermination à répondre aux exigences de ses clients et de ses partenaires. Le laboratoire du département matériel végétal de l’IFV est accrédité COFRAC (Comité Français d’Accréditation) pour la détection sur vigne par la méthode ELISA des virus responsables du court-noué, de l’enroulement (1, 2 et 3), de la marbrure, du GVA, du tomato ringspot et du tobacco ringspot (Accréditation n°1-1470, Essais, liste des sites accrédités et portée disponibles sur www.cofrac.fr). NB : étant donné la durée de vie du catalogue (10 ans environ), il est important de souligner ici que cette accréditation initiale a été délivrée à ENTAV-ITV France par le Cofrac le 01/02/2004 pour une durée limitée dans le temps. ENTAV-ITV France est par ailleurs régulièrement évalué par le Cofrac. Les lecteurs sont invités à vérifi er la validité de cette accréditation lorsqu’ils liront ces lignes sur le site du Cofrac : www.cofrac.fr. Cette accréditation est une reconnaissance offi cielle de la fi abilité et de la compétence technique attestée par des experts qualifi és et reconnus. La mise sous assurance qualité pour le dépistage des maladies à phytoplasmes (fl avescence dorée et bois noir) et pour l’identifi - cation variétale par technique PCR fait également partie des objectifs à court terme de l’Institut.”
Le test RT-PCR (Reverse Transcriptase - Polymerase Chain Reaction) est une technique génomique qui permet, à partir de l’ARN du virus, d’amplifier à l’aide d’amorces spécifi ques un fragment d’ADN obtenu par retro-transcription. Cette technique complémentaire utilisée ponctuellement, n’est pas encore développée en routine en France.
Principales maladies à virus
Indexage
Sérologie
Court-noué :
- Grapevine Fanleaf Virus
- GFLV - Arabis Mosaïc Virus
- ArMV
Rupestris du Lot
CNa (court-noué associé)
Enroulement :
- Grapevine LeafRoll associated Virus
- GLRaV
Cabernet franc N
Cabernet-Sauvignon N
Merlot N
Pinot noir N
GLRaV-1
GLRaV-2
GLRaV-3
Marbrure :
- Grapevine Fleck
- Virus -GFkV
Rupestris du Lot
GFkV
Maladies à virus secondaires
Indexage
Sérologie
Complexe du bois strié (ou Cannelures) :
- Rupestris Stem Pitting – RSP
- Kober Stem Grooving – KSG
- Grapevine Corky Bark – GCB
Rupestris du Lot
5 BB
LN 33
GVA
Maladies de type viral uniquement recherchées pour la sélection clonale des porte-greffes
Nécrose des nervures :
- Grapevine Vein Necrosis - GVN
110 R
Mosaïque des nervures :
- Grapevine Vein
- Mosaic - GVM
Riparia Gloire
L’arrêté du 20 septembre 2006 relatif à la sélection, à la production, à la circulation et à la distribution des matériels de multiplication végétative de la vigne précise notamment que :
“…les vignes-mères destinées à la production de matériel de multiplication initial sont exemptes des organismes nuisibles suivants :
- complexe de la dégénérescence infectieuse : virus du court-noué (ou des feuilles en palmette) de la vigne (GFLV) et virus de la mosaïque de l’arabette (ArMV)
- maladie de l’enroulement de la vigne : types 1 (GLRaV-1) et 3 (GLRaV-3) du virus associé à la maladie de l’enroulement de la vigne ;
- virus de la marbrure (GFkV), uniquement pour les porte-greffes.
Caractéristiques succinctes des viroses dépistées
Tous les virus sont des parasites obligatoires contre lesquels il n’existe pas de méthode de lutte directe. De plus, aucune variété cultivée de vigne n’est résistante aux viroses connues. La sélection sanitaire et le contrôle des vecteurs naturels des virus sont aujourd’hui les seules stratégies qui permettent de réduire la propagation des viroses. Des clones infectés par des virus peuvent être assainis par thermothérapie et/ou culture in vitro d’apex ou de méristème.

Symptômes de court-noué(ringspot) sur Rupestris du Lot

Détail d’un ringspot
Le court-noué
est la virose la plus importante et la plus répandue. Elle est provoquée en France, par deux Nepovirus : le GFLV (Grapevine Fanleaf Virus) transmis par le nématode Xiphinema index, et l’ArMV (Arabis Mosaic Virus) transmis par Xiphinema diversicaudatum. Les principaux symptômes du court-noué sont le raccourcissement des entre-nœuds, la croissance des sarments en zigzag, des doubles nœuds, l’asymétrie du limbe des feuilles, l’élargissement du sinus pétiolaire, l’élongation des dents, l’apparition de décolorations jaunes du limbe (panachure, mosaïque). Le nombre et la taille des grappes sont fortement réduits, avec une très forte coulure et/ou du millerandage. La durée de vie des ceps est généralement raccourcie. La lutte contre les vecteurs par l’utilisation de nématicides se heurte à plusieurs diffi cultés : leur ineffi cacité dans les sols lourds et profonds et les risques de toxicité et de pollution des eaux souterraines. La création par hybridation de variétés de porte-greffes résistants aux nématodes comme méthode de lutte alternative, est en cours d’évaluation.

Symptômes d’enroulement surCabernet franc N

Symptômes d’enroulement sur Cabernet-Sauvignon N
L’enroulement
viral se manifeste par l’enroulement des feuilles vers la face inférieure du limbe avec un rougissement pour les cépages rouges et un jaunissement pour les cépages blancs. Ces symptômes apparaissent sur les feuilles de la base des ceps à partir de la véraison puis s’étendent vers l’extrémité des sarments. La maturation des raisins est souvent retardée et irrégulière ; la récolte peut être diminuée en quantité et surtout en qualité (baisse de la teneur en sucres et en anthocyanes). Les variétés de porte-greffes n’extériorisent pas ou peu les symptômes caractéristiques de l’enroulement et peuvent être porteurs sains de virus. Plusieurs Ampelovirus et un Closterovirus (GLRaV-2) ont été décrits en association avec l’enroulement (GLRaV 1 à 10 = Grapevine LeafRoll associated Viruses). Les virus GLRaV-1 et 3 sont les plus répandus et ont une incidence avérée pour la viticulture. Quatre espèces de cochenilles (Phenacoccus aceris, Heliococcus bohemicus, Parthenolecanium corni et Pulvinaria vitis) sont reconnues vectrices potentielles de ces deux virus en France. Le virus GLRaV-2, également très répandu, semble avoir un effet dépressif moindre sur les variétés de vigne mais il engendre souvent des phénomènes d’incompatibilité au greffage avec le porte-greffe 5 BB. Il n’est pas transmis par les cochenilles.

Symptômes de RSP sur Rupestris du Lot
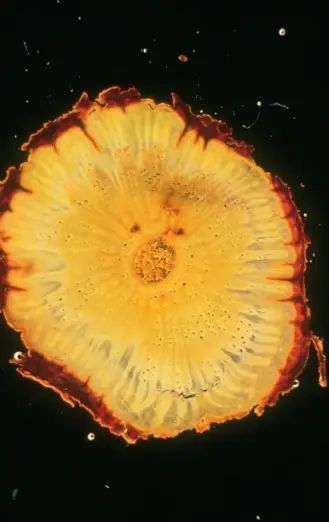
Symptômes de KSG sur 5BB

Symptômes d’écorce liégeuse sur LN 33
Le complexe du bois strié
est constitué de quatre syndromes qui se distinguent par les symptômes qu’ils induisent sur des variétés indicatrices : cannelures sur Rupestris (Rupestris Stem Pitting), cannelures sur 5 BB (Kober Stem Grooving), la maladie de l’écorce liégeuse (Grapevine Corky Bark) et cannelures sur LN 33 (LN 33 Stem Grooving), cette dernière virose relativement rare n’étant pas recherchée dans le schéma de sélection sanitaire français actuel. Au vignoble, les cannelures et la maladie de l’écorce liégeuse peuvent parfois se manifester par une diminution de vigueur, un léger retard de débourrement, un épaississement parfois liégeux au dessus du point de greffe. Au niveau du porte-greffe, le bois, sous l’écorce, peut montrer des striures ou des cannelures. Les récoltes et la durée de vie des ceps, peuvent dans certains cas être affectées. Il a été montré que le virus des cannelures sur Kober 5BB est associé au GVA (Grapevine Virus A) et est transmis par des cochenilles. L’écorce liégeuse, associée au GVB (Grapevine Virus B), est également transmissible par des cochenilles.

Symptômes de nécrose des nervures sur 110 R

Symptômes de mosaïque des nervures sur Riparia Gloire de Montpellier
Les maladies de type viral sont moins répandues ou peu préjudiciables. Ainsi, la nécrose des nervures et la mosaïque des nervures infectent de nombreuses variétés de manière latente.
Des agents pathogènes autres que des virus peuvent également être disséminés par les bois et plants de vignes : bactéries et phytoplasmes par exemple. Les phytoplasmes responsables de la fl avescence dorée (FD) ou du bois noir (BN) sont éliminés par immersion des boutures ou des greffés-soudés dans l’eau chaude (45 min à 50°C). Le traitement à l’eau chaude a également une action sur les bactéries responsables de la nécrose bactérienne (Xylophilus ampelinus), du broussin (Agrobacterium vitis) et de la maladie de Pierce (Xylella fastidiosa).
Le maintien du bon état sanitaire des clones sélectionnés, tout au long de la fi lière de propagation du matériel est essentiel. Cette exigence est satisfaite à la fois :
Sélection génétique
La sélection génétique représente l’autre volet de la sélection clonale, cette procédure est obligatoire et complémentaire de la sélection sanitaire. La sélection génétique se réalise en cinq étapes, effectuées à la fois au Domaine de l’Espiguette et dans la région d’origine de la variété, en collaboration avec les partenaires de l’IFV. Le protocole d’expérimentation des clones de vigne, approuvé par la section vigne du CTPS en 1998, défi nit les conditions d’acquisitions des références agronomiques et technologiques.
Etape 1. Prospections dans des vieilles parcelles de vigne ou présélection dans des conservatoires de clones
Cette toute première étape consiste en la sélection et la description ampélographique de souches choisies pour leurs caractéristiques. Ces observations sont réalisées du printemps jusqu’aux vendanges. Durant l’hiver, les sarments des souches marquées sont prélevés et sont ensuite introduits au Domaine de l’Espiguette.
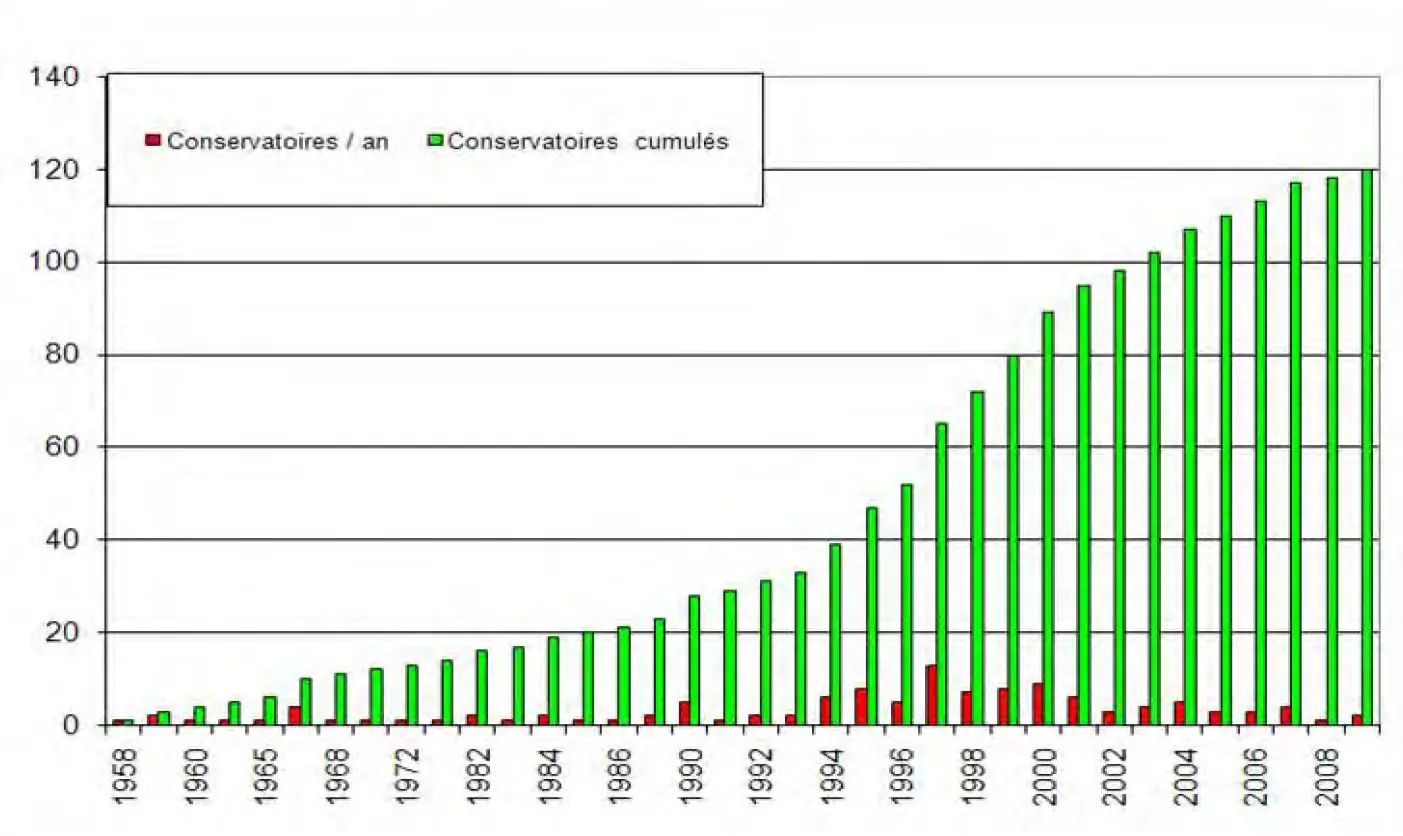
Les conservatoires de clones
L’IFV joue un rôle clé dans l’installation de conservatoires locaux. En effet, en plus de la collection présente sur le Domaine de l’Espiguette, 117 conservatoires régionaux dans l’ensemble des bassins viticoles sont établis afi n de maintenir la plus large diversité intra-variétale possible pour les principaux cépages. Ces collections comptent un total de plus de 18 000 clones concernant 105 cépages. Ces conservatoires représentent un potentiel stratégique pour les sélections futures. En effet, lorsque l’ensemble des plus vieilles parcelles aura été arraché, ces conservatoires seront l’unique ressource pour de prochaines sélections clonales. Le suivi de ces conservatoires est assuré par les partenaires de l’IFV. Le protocole d’installation, de gestion et d’étude des conservatoires de clones de vigne a été approuvé par la section vigne du CTPS en 2005.
Etape 3. Collection d’étude
Il s’agit d’une parcelle expérimentale dont l’objectif est l’évaluation des clones issus de prospections ou de conservatoires en vue de leur éventuel agrément. Installée suivant un protocole très précis, elle n’est composée que de clones ayant satisfait aux tests sanitaires vis à vis du court-noué et de l’enroulement. Les conditions sont les suivantes :
- sol homogène et terroir traditionnel pour la variété à étudier, présence d’au moins un clone certifi é témoin et d’un nombre maximum de 20 clones candidats
- suivi viticole de 5 années pour défi nir le profi l viticole du ou des clone(s) candidat(s),
- vinifi cations et dégustations d’au moins 3 millésimes pour évaluer le potentiel technologique et organoleptique du ou des clone(s) candidat(s).
Etape 4. Analyse de l’ensemble des données et demande d’agrément
Après analyse et synthèse des données viticoles et œnologiques et de l’état sanitaire des clones candidats et après consultation de ses partenaires, l’IFV demande l’agrément des clones jugés intéressants. C’est la section vigne du CTPS qui examine les propositions d’agrément que font les établissements de sélection IFV et INRA. La section vigne rend un avis qui est ensuite entériné par le Ministère de l’Agriculture. VINIFLHOR attribue alors un numéro offi ciel au clone nouvellement agréé.
Etape 5. Parcelles de comportement
Il s’agit de parcelles dont l’objet est l’étude de clones agréés, dans un site donné, en vue de comparer leurs caractéristiques culturales et les aptitudes technologiques et organoleptiques de leur produit, en fonction des facteurs du milieu. Les données obtenues à partir du suivi de ces parcelles sont utilisées afi n de conseiller les viticulteurs de la région considérée.









